أعلنت هيئة الدواء المصرية عن تسهيلات جديدة لتسجيل عدد من المستحضرات الدوائية الأكثر احتياجا في تلك الفترة، لمواجهة زيادة الطلب عليها.
وأوضحت هيئة الدواء أن ذلك يأتي فى ضوء التدابير الاحترازية التي تتخذها الهيئة للتعامل مع أى تداعيات محتملة لنقص بعض المستحضرات ودعم توافر بعض المستحضرات الهامة، فقد تمت الموافقة على ما يلي:
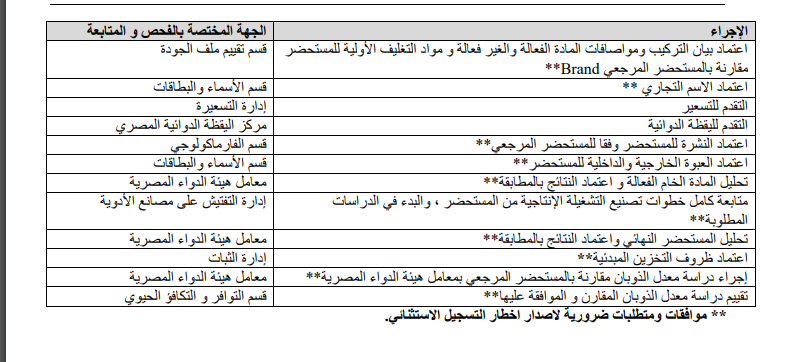
1 . فتح صندوق المثائل للمستحضرات التي تحتوي على المواد الفعالة التالية:
Hydroxychloroquine – Chloroquine – Oseltamivir – Azithromycin 500 mg Injection – Remdesivir –
Favipiravir
2 . تسريع الإجراءات اللازمة لتسجيل هذه المستحضرات تحت مسمى: of Authorization Use Emergency
Products Pharmaceutical طبقاً لآلية تسجيل معجلة بشرط انهاء الشركة لعدد من الاجراءات واالنتائج خلال 3 أشهر من تاريخ صدور الموافقة.
3 . تلتزم الشركة عند تصنيع المستحضر بنفس الشكل الصيدلى، وبيان التركيب ومواصفات المادة الفعالة والغير فعالة والتغليف الأولى للمستحضر المرجعى، وتمنح الشركة موافقة على ذلك لمتابعة الإجراءات.
4 . يتم إنتاج تشغيلة إنتاجية على مسئولية الشركة صاحبة المستحضر وذلك في حضور مفتش صيدلي لمتابعة خطوات الإنتاج كاملة، وحضور أخصائي رقابة من معامل هيئة الدواء المصرية لحضور التحليل واعتماد النتائج الخاصة بالمادة الفعالة والمستحضر النهائي.
5 . البدء في إجراء دراسة الثبات المعجلة لمدة 6 أشهر، على أن تعتبر مطابقة المعامل للمستحضر النهائي هي الـ time Zero وتستكمل دراسة الثبات المعجلة ويتم التحليل ومتابعة النتائج وفقا للقواعد المنظمة لتقييم دراسات الثبات.
6 . إجراء دراسة معدل الذوبان مقارنة بالمستحضر المرجعي بمعامل هيئة الدواء المصرية، وتستكمل دراسة التكافؤ الحيوي مقارنة بالمستحضر المرجعي وذلك وفقا للقواعد المنظمة لذلك.
7 . يمنح المستحضر إخطار تسجيل استثنائي مدته 8 أشهر بشرط صدور مطابقة المعامل للمادة الفعالة والمستحضر النهائي وكذلك دراسة معدل الذوبان بحد أدنى.
8 . يسمح بتداول التشغيلة الإنتاجية السابق الإشارة إليها في البند (4) والإفراج عنها تدريجيا طبقا للضرورة الملحة ومعدلات الاستهلاك بغرض التداول المحلي عن طريق المستشفيات الحكومية فقط، وفقا لنظام تتبع دوائي محدد ومتابعة ذلك من قبل التفتيش الصيدلي.
9 .تستكمل باقي الدراسات مثل الثبات والتكافؤ الحيوي و التسعير بعد صدور اخطار التسجيل االستثنائي ، ويتم متابعة موقف الانتهاء منها أولا بأول من قبل التفتيش الصيدلي.
10.يتم وقف التداول والاستخدام عند الإبلاغ عن أي مؤشرات تؤثر على فاعلية وأمان المستحضر وذلك من المستشفيات المختصة، أو رصدها عن طريق مركز اليقظة الدوائية المصري، وذلك طبقا للقواعد المنظمة لذلك. على أن يستمر العمل بهذه الإجراءات لحين إشعار أخر.
ونشرت هيئة الدواء جدول يوضح الجهات المختصة بالفحص والمتابعة لكل إجراء خلال عمليات التسجيل وجاء كالتالي: